近日,药学院戴建君/鞠艳敏团队在材料领域顶尖期刊Advanced Functional Materials(IF=19.924)上发表最新研究成果“Protonated charge reversal nanodrugs for active targeting clearance of Helicobacter pylori accompanied by gut microbiota protection”。药学院硕士生刘聪、生命科学与技术学院硕士生陈斯淼为本论文的共同第一作者。药学院戴建君教授、药学院鞠艳敏副研究员、北京大学侯仰龙教授、生命科学与技术学院邢莹莹副教授为本文的共同通讯作者。bwin必赢唯一官方网站为第一通讯单位。
幽门螺杆菌定植于胃粘膜下层且易形成生物膜,是慢性胃炎和消化性胃溃疡等疾病的重要致病因子,且已在2022年被美国卫生与公众服务部明确列为致癌物。临床上治疗幽门螺杆菌往往使用三联或者四联的抗生素疗法,但大剂量抗生素疗法会引起肠道菌群紊乱等副作用。此外,随着临床上耐药菌株的出现,人们对于抗生素药物安全的忧虑加重。因此,亟需寻找新的替代疗法。
针对以上问题,研究团队研制了一种可质子化的金属基纳米药物ZnO-Ag-mercaptoacetamide@chitosan(ZAN@CS MNDs)。研究发现,该纳米药物经巯基乙酰胺修饰获得电荷转换能力,在胃内酸性条件下质子化带正电荷,主动靶向带负电的幽门螺杆菌,破坏细菌细胞膜,瓦解生物膜结构,最终彻底清除细菌。体内实验证明,ZAN@CS经壳聚糖修饰后可穿透胃粘膜屏障,延长胃内滞留时间。使用该纳米药物治疗后,模型小鼠幽门螺杆菌胃部定植量显著降低,毒力因子CagA、VacA和尿素酶的表达水平明显下降。此外,ZAN@CS可调节免疫反应并减轻胃内炎症,治疗期间胃内CD4+ T细胞含量明显增加,促炎因子IL-6、IL-10和IFN-γ表达水平降低。同时,ZAN@CS在肠道不发生质子化作用,带自身负电荷,对小鼠肠道细菌菌种组成、功能相对丰度、菌种相对丰度均无影响,且在28小时后可完全被机体代谢清除。该研究为幽门螺杆菌治疗拓展了新的思路和方法。
以上工作获得国家自然科学基金(No. 52002402, No. 31872479),江苏省自然科学基金(No. BK20200574)等经费的资助。
原文链接:https://onlinelibrary.wiley.com/doi/epdf/10.1002/adfm.202300682
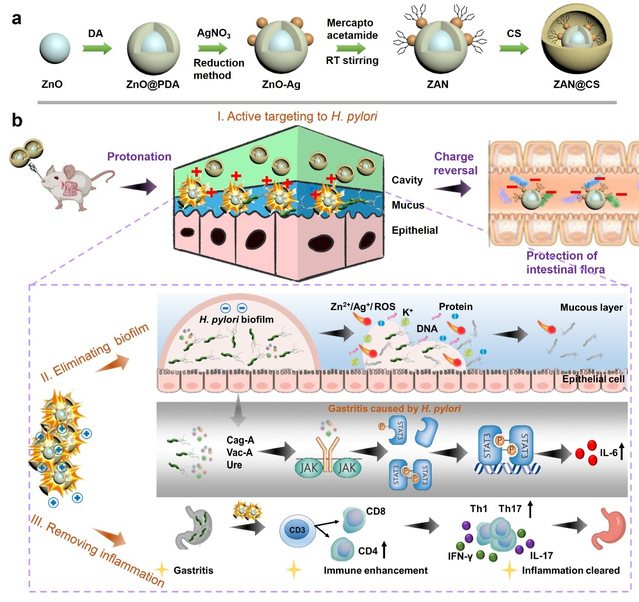
ZAN@CS MNDs的制备工艺及抗菌机理示意图
(供稿单位:药学院,撰写人:刘华,审稿人:黄欣、郑诗翌)




